На днях начал работу первый в России Биологический ресурсный центр исследования бактериофагов – вирусов, поражающих бактерии. Новая структура создана на базе компании «Микроген», входящей в холдинг «Нацимбио» Госкорпорации Ростех.
Центр станет своеобразной коллекцией, в которой уже насчитывается около 10 тыс. микроорганизмов. Это уникальный материал, на основе которого удастся создать новые препараты бактериофагов и в перспективе 5-7 лет разработать основу для перехода к персонализированной фаготерапии. Разбираемся, в чем преимущества бактериофагов и смогут ли они стать эффективным средством борьбы с инфекциями, с которыми не могут справиться антибиотики.
Бактериофаги – «пожиратели» бактерий
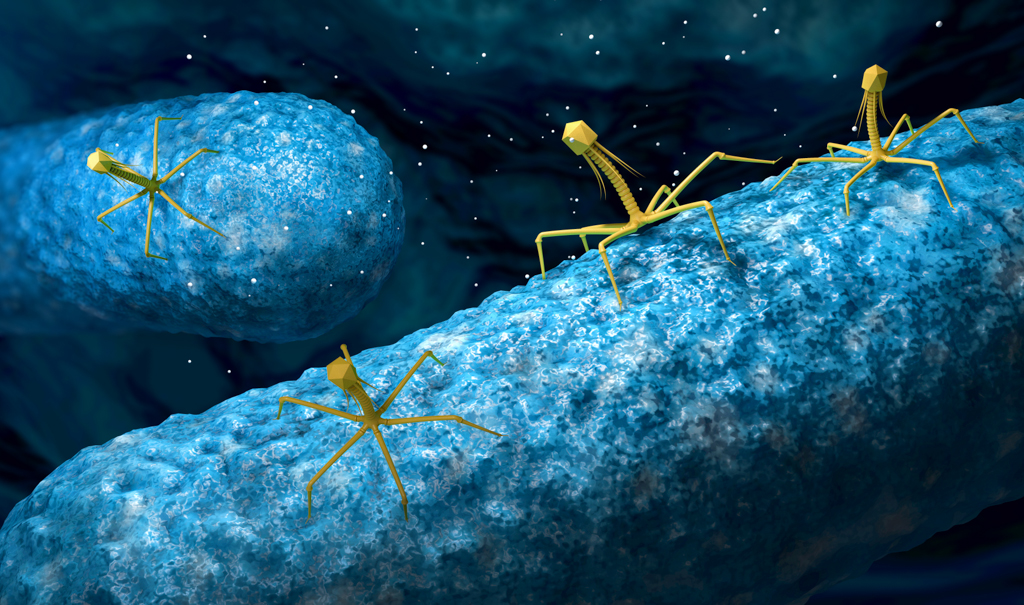
На самом деле, бактериофаги – это вирусы. Но только не те вирусы, которые поражают человека или животных. Бактериофаги уничтожают исключительно бактерии, или точнее – пожирают их (от греческого phagos – «пожиратель»). Эти миниатюрные (размером в среднем от 20 до 200 нанометров) враги бактерий очень распространены на нашей планете, найти их можно практически везде: в воде, глубоко под землей, в почве и даже в макроорганизмах. Бактериофаги используют в научных исследованиях, но, конечно, их основное практическое применение – борьба с бактериями.
Каждый бактериофаг поражает только те бактерии, против которых направлен. Когда фаг замечает «свою» бактерию, он моментально прикрепляется к оболочке ее клетки, после чего вводит собственную нуклеиновую кислоту (геном) внутрь бактерии. Его цель – заставить бактериальную клетку «работать на себя», то есть начать в ней процесс своего размножения.

Бактериофаговая активность. Маленькие пятна – область лизиса бактерий, вызванного фагами
Вскоре внутри бактерии формируются новые бактериофаги, и начинается процесс лизиса – распада бактериальной клетки и выход зрелых фагов. Таким образом, на свет появляются сотни новых бактериофагов, готовых к нападению. «Литический цикл» вновь повторяется. При всей своей кажущейся агрессивности, этот процесс абсолютно безвреден и не причиняет никаких побочных эффектов остальной микрофлоре организма.
Бактериофаги – далеко не новый биологический вид, а древнейшая группа вирусов. Ученые приступили к их изучению задолго до появления всем известных антибиотиков. Первые научные сообщения о бактериофагах появились еще в 1920-х годах. Многие тогда считали фаготерапию ключом к уничтожению бактериальных инфекций. Кстати, одним из основоположников фаготерапии стал грузинский микробиолог Георгий Элиава. В 1923 году он основал бактериологический институт в Тбилиси – первый в мире научно-исследовательский центр бактериофагологии. Через некоторое время к нему присоединился и сам первооткрыватель бактериофагов – француз Феликс Д’Эрелль. Кстати, именно он и придумал само название «бактериофаг».
В 1940 году бактериофагами заинтересовались за океаном – американские фармацевтические компании пытаются коммерциализировать идею фаготерапии. Но «фаготерапевтическому буму» вскоре приходит конец. Событие, которое отложило исследование фаготерапии на долгие годы – начало промышленного производства пенициллина. Несмотря на то что Александр Флеминг открыл пенициллин еще в 1928 году, первое время его идея не получила широкого применения из-за отсутствия возможности химического производства антибиотика. И только в начале 1940-х годов в Англии, США и СССР организуется промышленный выпуск пенициллина.
Бактерии vs. Человечество: глобальное сопротивление
Случайное открытие Флеминга ознаменовало начало новой эры в медицине. Человечество смогло побороть множество смертельных бактериальных заболеваний, которые на протяжении тысячелетий оставались неизлечимыми.
Но наряду с возможностями антибиотиков, Флеминг обнаружил и другое – при недостаточном количестве пенициллина или если его действие было непродолжительным, бактерии приобретали устойчивость к антибиотику. Флеминг об этом рассказывал в своих выступлениях по всему миру и не раз предупреждал, что не стоит использовать пенициллин, пока заболевание не будет диагностировано, а при необходимости применения антибиотика, его нельзя использовать в течение короткого времени и в совсем малых количествах. К сожалению, это предостережение не помогло.
Уже к 1945 году пенициллин стал доступен повсеместно, активно создавались и другие антибиотики. На протяжении последующих десятилетий они применялись практически бесконтрольно. К примеру, одной из проблем стало самолечение антибиотиками среди населения. Причем при самостоятельном выборе антибиотика часто предпочтение отдавалось именно препаратам широкого спектра действия. Антибиотики стали также широко применяться в сельском хозяйстве – до 80% всех антибиотиков в мире используют для лечения скота. Все это ускорило темпы формирования «антибиотикорезистентности» (от английского resist – «сопротивляться») и привело к тому, что многие инфекционные заболевания снова стали неизлечимы.
Легионеллы – патогенные грамотрицательные бактерии
«Все хотят жить, в том числе и микробы, – рассказывает РИА «Новый день» доктор медицинских наук Тамара Перепанова. – Они развивают сопротивляемость. И эта борьба складывается в пользу микроорганизмов. Они вырабатывают новые штаммы быстрее, чем все фармакологии мира разрабатывают новые препараты. И вот уже антибиотик неэффективен». К слову, самый первый антибиотик – пенициллин – практически бесполезен сегодня: у бактерий к нему развилась почти полная устойчивость.
В 2017 году Всемирная организация здравоохранения (ВОЗ) впервые опубликовала список устойчивых к действию антибиотиков «приоритетных патогенов» – 12 видов бактерий, представляющих наибольшую угрозу для здоровья человека. В их числе – Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacteriaceae, Enterococcus faecium, Staphylococcus aureus, Helicobacter pylori, Campylobacter spp., Salmonellae, Neisseria gonorrhoeae, Streptococcus pneumoniae, Haemophilus influenzae, Shigella. За всеми этими названиями – очень серьезные заболевания: сепсис, менингит, пневмония, брюшной тиф, дизентерия и другие.
По данным ВОЗ практически все существующие патогенные для человека бактерии приобретут устойчивость к антибиотикам уже через 10-20 лет. По прогнозам, к 2050 году число жертв бактериальных инфекций возрастет до 10 млн в год. Кстати, с уверенностью можно констатировать, что для любого жителя нашей страны вероятность подцепить бактериальную инфекцию, устойчивую ко всем основным антибиотикам, сейчас гораздо выше, чем заразиться вирусом из Китая.
Антибиотики и бактериофаги – оружие против одного врага
Сегодня существующие антибиотики в большинстве случаев все еще работают. Но ученые уже назвали борьбу с бактериями «главным вызовом времени». Проблема антимикробной резистентности рассматривается на глобальном уровне, и мировое научное сообщество активно ищет пути ее решения. Конечно, первый выход из ситуации – это создание новых видов антибиотиков. Но на разработку одного препарата, его клинические испытания и внедрение в массовое производство уходит в среднем 10 лет. Второй явный минус – это стоимость: создание нового антибиотика обходится в миллиарды долларов.
Поэтому ученые все чаще стали вспоминать «старую» альтернативу антибиотикам – бактериофаги. Как отмечают эксперты отрасли, создание бактериофага обходится в десятки раз дешевле, чем антибиотика. Но главное преимущество фагов – не в стоимости, а в их способности изменяться вслед за бактерией. Кроме того, бактериофаги не имеют побочных эффектов и не нарушают естественную флору организма.
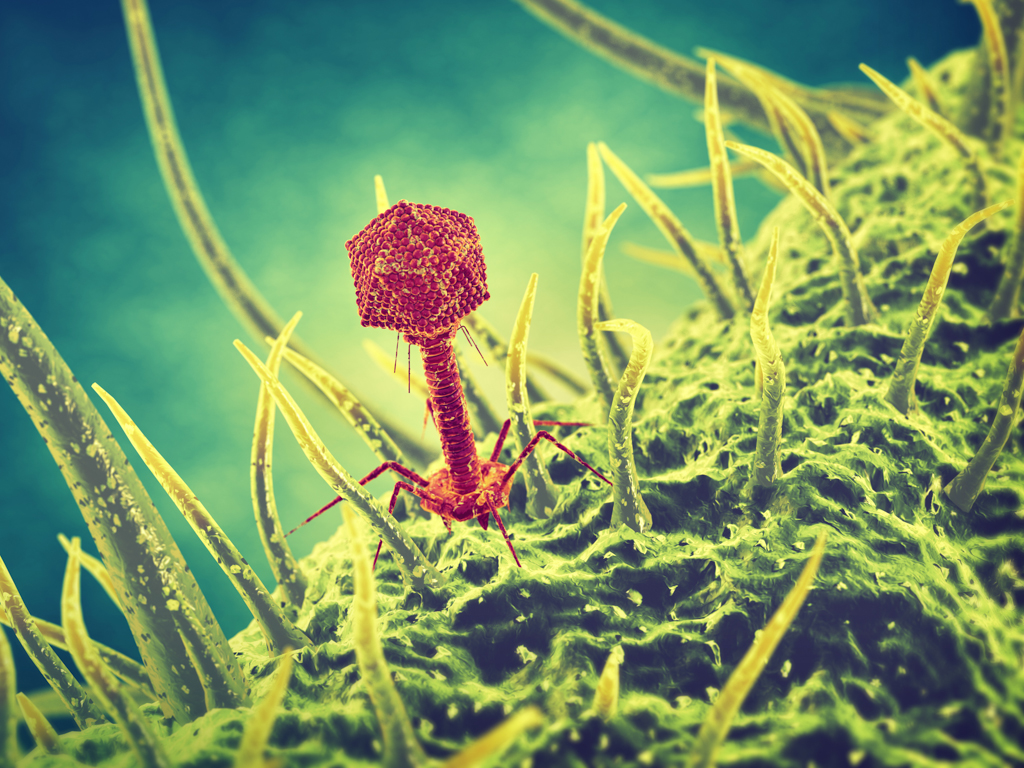
Структура типичного миовируса бактериофага
Тем не менее антибиотики никуда не исчезнут с полок аптек и из арсенала врачей. Как отмечают специалисты, антибиотики и бактериофаги – оружие против одного врага. Только действуют они по-разному. Антибиотики можно сравнить с тяжелой артиллерией. Они необходимы, когда действовать нужно быстро, и возможные побочные эффекты меркнут перед критическим состоянием пациента. Бактериофаги – это снайпер, который прицельно уничтожает только один вид бактерий.
Действительно, плюс антибиотиков – отсутствие узкой специализации. Один антибиотик способен лечить довольно широкий круг бактериальных инфекций. Но, как уже отмечалось выше, не обходится без побочных эффектов – от антибиотиков страдают не только инфекционные бактерии, но и полезные бактерии нашей микрофлоры. Поэтому длительное употребление антибиотиков нередко вызывает дисбактериоз.
Бактериофаги обладают узкой специализацией, поэтому для каждой бактерии нужно выделить свой терапевтический фаг. Положительная сторона такой специализации – более «прицельный» удар: ликвидируется только инфекционная бактерия, а полезные не страдают.
Фаготерапия по-русски
Эксперты отмечают, что производство бактериофагов – весьма перспективное направление в фармацевтической промышленности. Кстати, наша страна в производстве бактериофагов исторически занимает ведущие позиции. Уже в годы Великой Отечественной войны применялась фаготерапия. Особое внимание уделялось разработке бактериофагов против кишечных инфекций – холеры, брюшного тифа, дизентерии и сальмонеллеза. Всего в военное время для фронта было изготовлено более 200 тыс. литров бактериофагов.
Сегодня в нашей стране развитие производства лекарственных препаратов на основе бактериофагов входит в Стратегию предупреждения распространения антимикробной резистентности в Российской Федерации до 2030 года, принятую Правительством РФ. Единственный в стране производитель препаратов бактериофагов – компания «Микроген» холдинга «Нацимбио» Госкорпорации Ростех. В период с 2017 по 2019 год продажи бактериофагов «Микрогена» выросли более чем на 25% в денежном выражении.
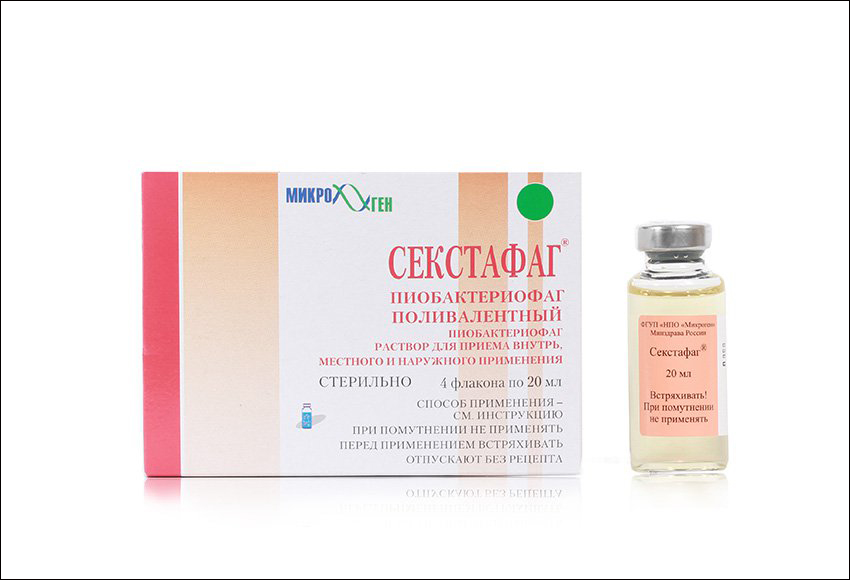
Компанией разработаны и выпускаются 19 наименований лекарств на основе бактериофагов против множества известных возбудителей инфекционных заболеваний: дизентерии, брюшного тифа, сальмонеллеза, гнойно-септических и других. Кроме того, разработаны комбинированные препараты, например «Секстафаг» (Пиобактериофаг поливалентный). Он обладает способностью справиться с бактериями стафилококков, стрептококков (в том числе энтерококков), протея, клебсиелл пневмонии, синегнойной и кишечной палочек. Данный препарат отличается высокой степенью очистки от бактериальных метаболитов, что позволяет успешно использовать его для лечения новорожденных и детей раннего возраста, а также применять для беременных.
В рамках Стратегии по борьбе с антимикробной резистентностью ученые НПО «Микроген» проводят множество исследований. В настоящий момент предприятие приступило к созданию первого в России Биологического ресурсного центра для углубленного изучения бактериофагов.
«Задача Биологического ресурсного центра – объединить микробные производственные коллекции, собранные на территории России. На данный момент это более 10 тыс. штаммов. В коллекцию также входят бактериофаги для терапевтических целей. Это уникальный материал, представляющий собой государственную ценность, на его основе удастся создать новые виды лекарств», – прокомментировал исполнительный директор Госкорпорации Ростех Олег Евтушенко.
Но, пожалуй, самой амбициозной целью нового центра является создание основы для перехода к персонализированной фаготерапии в ближайшие 5-7 лет. Персонально подобранный «коктейль» из бактериофагов может спасти жизнь пациентам, которым уже не помогают антибиотики.
Успехи российских и зарубежных ученых вселяют надежду на то, что проблема антимикробной резистентности в скором времени может быть преодолена. Тем временем каждый из нас в этой борьбе с «супербактериями» может внести свой маленький вклад – соблюдать правила, которые помогут уберечься от вирусов и бактерий, остановить появление новых опасных инфекций. Все просто: не забывать о гигиене, вести здоровый образ жизни, вовремя обращаться к врачам и ограничить использование антибиотиков.

